Activistas y organizaciones de salud de todo el mundo denuncian que los retrasos regulatorios de la farmacéutica impiden el acceso a una herramienta de prevención del VIH que podría administrarse cada seis meses y ofrecer protección casi total.
Lima – Perú.- Un total de 277 organizaciones, activistas, académicos y expertos en políticas de todo el mundo han enviado una carta abierta al CEO de Gilead, Daniel O’Day, exigiendo que la farmacéutica acelere las solicitudes de aprobación regulatoria del lenacapavir inyectable de acción prolongada (LEN-LA) para uso en profilaxis preexposición (PrEP) del VIH en todos los países de ingresos bajos y medianos (PIBM).
El reclamo surge ante nuevos retrasos regulatorios que, según las organizaciones firmantes, están bloqueando el acceso a una herramienta innovadora que podría transformar la prevención del VIH. La carta está respaldada por organizaciones como Health GAP, Public Citizen, Salud por Derecho, Acción Internacional para la Salud (AIS Perú), Médicos Sin Fronteras, Amref Health Africa, Associação Brasileira Interdisciplinar de AIDS, Health Justice Initiative, Sankalp Rehabilitation Trust y Treatment Action Campaign, entre otras.
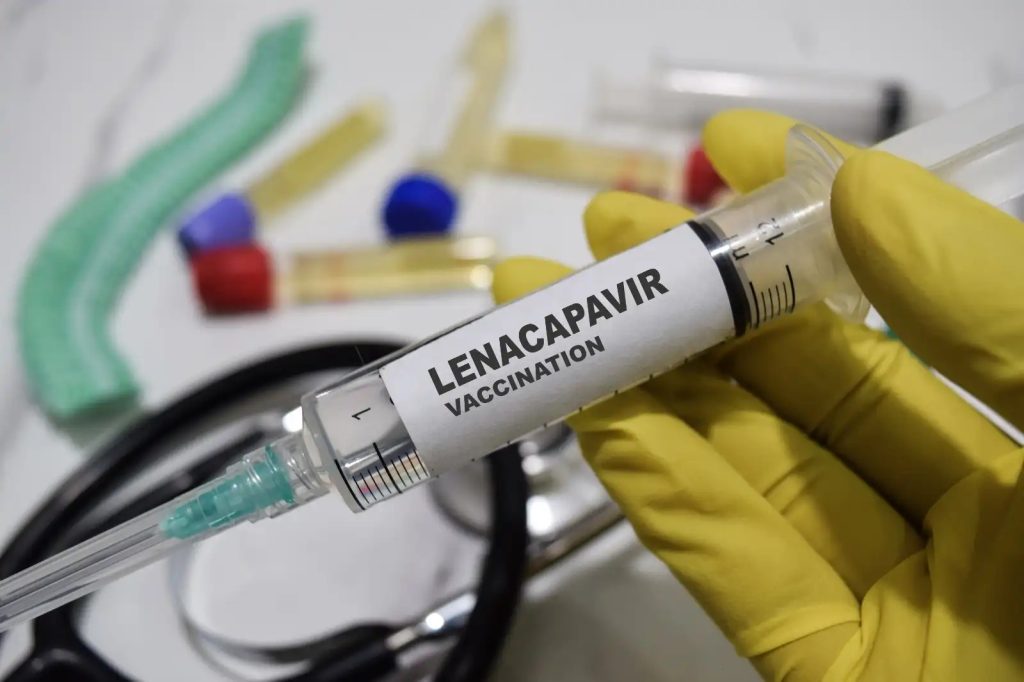
A pesar de haber participado en ensayos clínicos, la mayoría de los países de América Latina y el Caribe —incluidos Perú, México, Brasil y Argentina— están excluidos de los acuerdos de acceso genérico. Esto significa que, legalmente, los fabricantes no pueden distribuir versiones genéricas en estos países, incluso si los gobiernos emiten licencias obligatorias.
“Después de negarse a revelar el precio de acceso a LEN-LA, ahora se niegan a comprometerse rápidamente con la solicitud de aprobación regulatoria en los países de ingresos bajos y medios. Esto es inconcebible. El lenacapavir para la PrEP podría ayudar a acelerar el fin de esta pandemia”, señaló Bellinda Thibela, coordinadora de política internacional y promoción de Health GAP.
Las organizaciones denunciaron que Gilead está excluyendo a decenas de países con alta incidencia de VIH de su estrategia de acceso y que las licencias voluntarias que propone tienen restricciones insostenibles.
Entre las demandas dirigidas a O’Day están:
- Acelerar las solicitudes de aprobación regulatoria en todos los PIBM.
- Revelar la lista completa de países identificados para registro bajo el mecanismo EU-M4all y ampliarla a todas las naciones de ingresos bajos y medios.
- Solicitar el registro en todos los países que confíen en la aprobación de la UE una vez finalizado el proceso.
- Agilizar la precalificación de la OMS y el registro colaborativo para todos los PIBM, no solo para los 66 países actuales.
Lenacapavir: un avance clave en la prevención
El lenacapavir es una inyección semestral que, en ensayos clínicos, demostró protección casi total contra el VIH. La OMS, en sus guías publicadas el 14 de julio, recomienda su uso para todas las personas en riesgo de infección, incluidas poblaciones clave como trabajadoras sexuales, personas LGBTQ+, personas que usan drogas y mujeres cisgénero heterosexuales en África subsahariana.
Actualmente, la producción del fármaco podría costar solo 25 dólares anuales, pero en Estados Unidos su precio es de 28,218 dólares por año. Activistas advierten que retrasos como los de Gilead pueden costar vidas en contextos de alta vulnerabilidad.
¿Qué empresas producirán la versión genérica?
Las siguientes seis empresas han sido autorizadas para fabricar versiones genéricas de lenacapavir:
- Dr. Reddy’s Laboratories (India)
- Emcure Pharmaceuticals (India)
- Hetero Labs (India)
- Mylan–Viatris (India/EE.UU.)
- Eva Pharma (Egipto)
- Ferozsons Laboratories (Pakistán)
Situación del VIH en Perú
Según el Ministerio de Salud, en Perú se notifican más de 3,000 nuevos casos de VIH cada año, y se estima que alrededor de 90,000 personas viven con el virus. La epidemia afecta de manera desproporcionada a hombres que tienen sexo con hombres, mujeres trans, trabajadores sexuales y jóvenes.
A la par, el sistema de vigilancia comunitaria GIVAR reportó que 67% de las denuncias recibidas en 2024 estuvieron relacionadas con desabastecimiento de medicamentos antirretrovirales (ARV), incluyendo TLD, Dolutegravir, Abacavir y Efavirenz. Este problema pone en riesgo la continuidad del tratamiento y la salud de miles de personas viviendo con VIH en el país.

